Bộ đề bình chọn Hóa 8 chương 1 bao hàm 9 đề đánh giá 45 phút tất cả ma trận kèm theo đáp án. Qua đó giúp các em học viên có thêm những tài liệu sử dụng ôn tập cho bài xích kiểm tra 1 tiết sắp tới tới.
Bạn đang xem: Đề kiểm tra 1 tiết hóa 8 lần 1
Đề kiểm soát Hóa 8 chương 1 nhằm mục đích để kiểm tra, reviews việc học tập tập của những em học sinh sau mỗi chương học. Tư liệu được biên soạn bám quá sát nội dung công tác học trong sách giáo khoa. Đồng thời đây là tài liệu hữu ích cho những thầy giáo, giáo viên và các bậc phụ huynh góp cho con em mình học tập tốt hơn. Vậy sau đó là Bộ 9 đề khám nghiệm 1 tiết hóa học 8 chương 1, mời các bạn cùng theo dõi và quan sát tại đây.
Bộ đề kiểm tra Hóa 8 chương 1 (Có đáp án)
Đề bình chọn 1 tiết Chương 1 chất hóa học 8 - Đề 1Đề soát sổ 1 tiết Chương 1 hóa học 8 - Đề 2Đề đánh giá 1 tiết Chương 1 hóa học 8 - Đề 1
Ma trận đề khám nghiệm 1 ngày tiết Hóa 8
| Chủ đề | Nhận biết | Thông hiểu | Vận dụng thấp | Vận dụng cao | ||||
| TN | TL | TN | TL | TN | TL | TN | TL | |
| Chất | Xác định chất, trang bị thể | Nước tinh khiết | Tách muối ra khỏi hỗn đúng theo nước muối | |||||
| 25% = 2.5đ | 80% = 2đ | 10% = 0.25đ | 10% = 0.25đ | |||||
| 1 | 1 | 1 | ||||||
| Nguyên tử | Cấu chế tác của phân tử nhân | Cách trình diễn số nguyên tử, phân tử. | So sánh cân nặng giữa các nguyên tử, phân tử | |||||
| 10% = 1đ | 25% = 0.25đ | 50% = 0.5đ | 25% = 0.25đ | |||||
| 1 | 2 | 1 | ||||||
| Nguyên tố hóa học | Đặc trưng của một nguyên tố | |||||||
| 2.5% = 0.25đ | 100% = 0.25đ | |||||||
| 1 | ||||||||
| Đơn chất, hợp chất, phân tử | Tính phân tử khối của phù hợp chất.Xác định đơn chất kim loại, hòa hợp chất | |||||||
| 25% = 2.5đ | 100% = 2.5đ | |||||||
| 2 | 1 | |||||||
| Công thức hóa học | Lập CTHH | Xác định tên nguyên tử của nguyên tố lúc biết PTK | ||||||
| 12.5% = 1.25đ | 20% = 0.25đ | 80% = 1đ | ||||||
| 1 | 1 | |||||||
| Hóa trị | Hóa trị của H và O | Xác định hóa trị cùng tìm công thức hóa học lúc biết hóa trị | ||||||
| 25% = 2.5đ | 10% = 0.25đ | 90% = 2.25đ | ||||||
| 1 | 1 | 1 | ||||||
Tổng số câu: Tổng số điểm: | 2TN 1TL 2.5đ = 25% | 6TN 1TL 3.5đ = 35% | 4TN 1TL 3đ = 30% | T 1TL 1đ = 10% |
Đề kiểm tra chương 1 hóa học lớp 8
I. Trắc nghiệm. (Chọn cách thực hiện đúng nhất trong những câu sau) (3đ)
Câu 1. Trong phân tử nhân nguyên tử, thì có những loại hạt nào
A. Proton, electron
B. Proton, notron.
C. Electron.
D. Electron, proton, notron.
Câu 2. Hóa trị của 1 nguyên tố được xác minh theo hóa trị của yếu tắc khác như vậy nào?
A. H chọn làm 2 1-1 vị
B. O là một trong đơn vị.
C. H chọn làm 1 1-1 vị, O là 2 1-1 vị.
D. H chọn làm 2 đối kháng vị, O là 1 đơn vị.
Câu 3. hóa học nào sau đây được xem là tinh khiết
A. Nước cất.
B. Nước suối.
C. Nước khoáng.
D. Nước đá từ nhà máy.
Câu 4. Dãy chất sau đây đều là hợp chất ?
A. Cl2, KOH, H2SO4, Al
Cl3
B. Cu
O, KOH, H2SO4, Al
Cl3
C. Cu
O, KOH, Fe, H2SO4.
D. Cl2, Cu, Fe, Al
Câu 5. Dãy hóa học nào tiếp sau đây đều là kim loại
A. Nhôm, đồng, lưu huỳnh, tệ bạc .
B. Vàng, magie, nhôm, clo.
C. Oxi, nitơ, cacbon, canxi.
D. Sắt, chì, kẽm , thiếc.
Câu 6. có thể tách muối thoát ra khỏi hỗn vừa lòng nước muối bằng cách:
A. Thêm muối
B. Thêm nước
C. Đông lạnh
D. Đun nóng
Câu 7. Số…..là số đặc trưng của một yếu tắc hóa học.
A. Proton
B. Notron
C. Electron
D. Notron với electron
Câu 8. Phân tử ozon gồm bố nguyên tử oxi. Cách làm của ozon là
A. 3O
B. 3O2
C. O3
D. 3O3
Câu 9: cách viết làm sao sau đó là sai:
A. 4 nguyên tử natri : 4Na
B. 1 nguyên tử nitơ: N
C. 3 nguyên tử canxi: 3C
D. 2 nguyên tử sắt: 2 Fe
Câu 10: Năm phân tử hiđro viết là:
A. 5H
B. 5H2
C. H2
D. 5 h2
Câu 11: Phân tử hiđro nhẹ nhàng hơn bao nhiêu lần đối với phân tử oxi?
A. 0,0625
B. 0,625
C. 0,125
D. 1,25
Câu 12: Một oxit tất cả công thức là Fe2Ox bao gồm PTK là 160 đv
C. Hóa trị của fe trong oxit là:
A. I
B. II
C. III
D. IV
II. Từ bỏ luận.(7đ)
Câu 1. (2đ)Hãy đã cho thấy đâu là chất, đâu là vật thể trong những câu sau đây?
a). Than chì là chất sử dụng làm lõi cây viết chì.
b) xe đạp điện được sản xuất từ sắt, nhôm, cao su…
Câu 2. (2đ) Viết bí quyết hóa học và tính phân tử khối của hợp chất sau:
a) canxi oxit, biết trong phân tử có một Ca với 1 O
b) Đồng sunfat, biết vào phân tử có 1 Cu, 1 S cùng 4 O.
Câu 3. (2đ)
a) xác minh hóa trị của nguyên tố sắt trong hợp chất sau: Fe
Cl2? Biết Cl bao gồm hóa trị I
b) Lập bí quyết hóa học của các hợp chất sau: Cu (II) và O ; Al ( III) cùng SO4(II).
Câu 4. (1đ)Trong phân tử một hợp chất được tạo vì chưng 2 nguyên tử nguyên tố R và 5 nguyên tử yếu tắc oxi. Kiếm tìm nguyên tử khối cùng tên yếu tắc R. Biết hợp hóa học này nặng rộng phân tử hidro 71 lần.
( cho biết: H =1; C =12; N =14; O =16; p =31; S =32; Ca =40; fe =56; Cu =64)
Đáp án đề chất vấn 1 tiết hóa học 8
I. Trắc nghiệm. (2 điểm) mỗi câu đúng 0,25đ
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
B | C | A | B | D | D | A | C | B | B | A | C |
II. Từ luận. (8 điểm)
| CÂU | NỘI DUNG | ĐIỂM | |
1 (2đ) | a | b | |
| Chất | Than chì | Sắt, nhôm, cao su… | |
| Vật thể | Bút chì | Xe đạp |
1đ
1đ
2
(2đ)
a. CT: Ca
O
PTK= 56 đv
C
b. CT: Cu
SO4
PTK= 160 đv
C
0,5đ
0,5đ
0,5đ
0,5đ
3
(2đ)
a. Fe
Cl2 thì Fe bao gồm hóa trị II
b. Cu (II) với O => Cu
O
Al ( III) và SO4 (II) => Al2(PO4)3
1đ
0,5đ
0,5đ
4
(1đ)
CT: R2O5
PTK= 2R+ 5.16=71.2
=> R=31
=> R là photpho
0,25đ
0,25đ
0,25đ
0,25đ
Đề kiểm tra 1 ngày tiết Chương 1 hóa học 8 - Đề 2
Ma trận đề chất vấn 1 tiết hóa học 8
| Cấp độ Tên công ty đề | Nhận biết | Thông hiểu | Vận dụng | Tổng | |||||
| Cấp độ thấp | Cấp độ cao | ||||||||
| TNKQ | TL | TNKQ | TL | TNKQ | TL | TNKQ | TL | ||
| Chủ đề 1:Nguyên tử, yếu tố hóa học | Chỉ ra được thành phần cấu tạo nguyên tử, trọng lượng nguyên tử, nguyên tử khối. | So sánh cân nặng của một số trong những nguyên tử. | Xác định tên nhân tố từ sự nặng nhẹ giữa những nguyên tử. | ||||||
| Số câu | 4 | 1 | 1 | 6 | |||||
| Số điểm | 1 | 1,5 | 0,25 | 2,75 | |||||
| Tỉ lệ | 10%. | 15% | 2,5% | 27,5%. | |||||
| Chủ đề 2:Đơn chất-Hợp chất | Nhận ra được đối kháng chất thích hợp chất. | Phân loại đơn chất phù hợp chất. | |||||||
| Số câu | 1 | 3 | 4 | ||||||
| Số điểm | 0,25 | 0,75 | 1 | ||||||
| Tỉ lệ | 2,5% | 7,5%. | 10%. | ||||||
| Chủ đề 3:Công thức hóa học | Xác định được CTHH của đơn chất. | Viết đúng CTHH của phù hợp chất khi biết tên nguyên tố và số nguyên tử mỗi nguyên tố trong một phân tử. | Phân tích được các ý nghĩa CTHH của chất nỗ lực thể.Xác định CTHH của thích hợp chất khi biết PTK của hóa học hoặc lúc biết tên nguyên tố với số nguyên tử từng nguyên tố trong 1 phân tử. | Giải quyết được câu hỏi liên quan đến ý nghĩa CTHH của chất thay thể. | |||||
| Số câu | 1 | 2 | 3 | 1 | 7 | ||||
| Số điểm | 1,5 | 0,5 | 0,75 | 1,5 | 4,25 | ||||
| Tỉ lệ | 15% | 5% | 7,5% | 15% | 42,5% | ||||
| Chủ đề 4:Tổng hợp | Xác định CTHH của đúng theo chất lúc biết hai CTHH cho trước.Xác định NTK của nguyên tố từ CTHH, PTK của chất. | Xác định tên các nguyên tố từ một trong những CTHH, PTK của hóa học và sự nặng dịu giữa những nguyên tử. | |||||||
| Số câu | 2 | 1 | 3 | ||||||
| Số điểm | 0,5 | 1,5 | 2 | ||||||
| Tỉ lệ | 5% | 15% | 20% | ||||||
Số câu | 6 2,75 27,5% | 6 2,75 27,5% | 5 2,5 25% | 3 2 20% | 20 | ||||
| Số điểm | 10 | ||||||||
| Tỉ lệ | 100 % |
Đề soát sổ 1 tiết chất hóa học 8
A. TRẮC NGHIỆM (4,0 ĐIỂM)
Khoanh tròn vào câu vấn đáp đúng nhất trong những câu sau:
Câu 1. Trong nguyên tử có những hạt mang điện là:
A. Nơtron, electron.
B. Proton, electron.
C. Proton, nơtron, electron.
D. Proton, nơtron.
Câu 2. Hầu hết các nguyên tử đầy đủ được chế tạo ra thành từ những hạt
A. Proton cùng electron.
B. Nơtron và electron.
C. Proton và nơtron.
D. Proton, nơtron cùng electron.
Câu 3. Trong nguyên tử luôn luôn có
A. Số proton ngay số electron.
B. Số proton thông qua số nơtron.
C. Khối lượng electron bằng khối lượng proton.
D. Trọng lượng nơtrơn bằng khối lượng electron.
Câu 4. Nguyên tử khối là trọng lượng của một nguyên tử tính bằng đơn vị nào?
A. Gam (g).
B. Kilogam (kg).
C. Đơn vị cacbon (đv
C).
D. Miligam (mg).
Câu 5. Trong số các chất mang lại dưới đây, hãy chỉ ra hóa học nào là 1-1 chất?
A. Khí amoniac khiến cho từ N cùng H.
B. Photpho đỏ làm cho từ P.
C. Khí hiđro clorua tạo nên từ H cùng Cl.
D. Magie oxit tạo cho từ Mg và O.
Câu 6. Dãy gồm những công thức hóa học của các chất gần như là hợp hóa học là
A. Ca
O; Cl2; CO; CO2.
B. Cl2; N2; Mg; Al.
C. CO2; Na
Cl; Ca
CO3; H2O.
D. Cl2; CO2; Ca(OH)2; Ca
SO4.
Câu 7. Phân tử khối của nhôm sunfat Al2(SO4)3 là
A. 324 đv
C
B. 342 đv
C.
C. 75 đv
C.
D. 278 đv
C.
Câu 8. Cho cách làm hóa học những chất: H2, CO2, Al, H2SO4, Ca
O. Cho biết có mấy 1-1 chất, mấy đúng theo chất?
A. 3 1-1 chất và 2 hòa hợp chất.
B. 2 đơn chất cùng 3 vừa lòng chất.
C. 4 1-1 chất cùng 1 hòa hợp chất.
D. 1 solo chất và 4 vừa lòng chất.
Câu 9. Một phù hợp chất có phân tử bao gồm 1 nguyên tử S links với 2 nguyên tử O. Cách làm của hợp hóa học là
A. SO2.
B. S2O.
C. SO3.
D. SO.
Câu 10. Trong những chất sau, hóa học nào là đúng theo chất?
A. Khí oxi.
B. Nhôm.
C. Photpho.
D. Canxi clorua.
Câu 11. Từ công thức hóa học can xi cacbonat Ca
CO3 ta biết được
A, hợp hóa học trên bởi vì 3 nguyên tử Ca, C, O sinh sản nên.
B. Hợp hóa học trên gồm phân tử khối là 68 đv
C.
C. Hợp chất trên do một nguyên tố Ca, 1 nguyên tố với 3 yếu tắc O kết cấu nên.
D. Hợp hóa học trên bởi 3 nguyên tố là Ca, C, O kết cấu nên.
Câu 12. Một hợp chất X2Y3 có phân tử khối bởi 160 đv
C. Cách làm của hợp hóa học là
A. Al2S3.
B. Fe2O3.
C. Cr2O3.
D. Fe2S3.
Câu 13. Hợp hóa học (X) được chế tạo ra thành từ bỏ 9 nguyên tử oxi; 1 nguyên tử Al với 3 nguyên tử N. Phương pháp đúng của (X) là
A. Al3NO9.
B. Al3N1O9.
B. Al(N3O3)3.
D. Al(NO3)3.
Câu 14. Nguyên tử X nặng rộng nguyên tử oxi 2,5 lần. X là
B. Na.
C. K.
D. Br.
Câu 15. cho biết công thức hóa học hợp hóa học của nhân tố X với O và hợp hóa học của yếu tắc Y với H như sau: XO, YH3. Bí quyết hóa học đúng cho hợp chất chứa hai nguyên tố X với Y là
A. XY.
B. X2Y3.
C. X3Y2.
D. X2Y.
Câu 16. Một phù hợp chất có công thức Na2MO3 và tất cả phân tử khối bằng 106 đv
C. Nguyên tử khối của M là
A. 24 (đv
C).
B. 27 (đv
C).
C. 28 (đv
C).
D. 12 (đv
C).
II. TỰ LUẬN (6,0 ĐIỂM )
Câu 1.(1,5 điểm) Viết cách làm hóa học của những đơn chất: kali, bạc, kẽm, hiđro, nitơ, clo.
Câu 2. (1,5 điểm) Hãy đối chiếu xem nguyên tử lưu hoàng nặng hay dịu hơn, bởi bao nhiêu lần so với:
a. Nguyên tử oxi.
b. Nguyên tử đồng.
Câu 3. (1,5 điểm) Từ công thức hóa học tập của canxi photphat: Ca3(PO4)2ta biết được điều gì?
Câu 4. (1,5 điểm) Công thức hoá học tập hợp chất của yếu tắc M với nguyên tố O là M2O3 với hợp chất của yếu tố M với nhóm nguyên tử (XO4) là M2(XO4)3. M2(XO4)3 có phân tử khối bằng 400 đv
C (Biết rằng 4 nguyên tử M nặng bằng 7 nguyên tử X). Xác định tên của nhị nguyên tố M, X.
Đề thi lớp 1
Lớp 2Lớp 2 - kết nối tri thức
Lớp 2 - Chân trời sáng tạo
Lớp 2 - Cánh diều
Tài liệu tham khảo
Lớp 3Lớp 3 - kết nối tri thức
Lớp 3 - Chân trời sáng tạo
Lớp 3 - Cánh diều
Tài liệu tham khảo
Lớp 4Sách giáo khoa
Sách/Vở bài bác tập
Đề thi
Lớp 5Sách giáo khoa
Sách/Vở bài tập
Đề thi
Lớp 6Lớp 6 - kết nối tri thức
Lớp 6 - Chân trời sáng tạo
Lớp 6 - Cánh diều
Sách/Vở bài tập
Đề thi
Chuyên đề và Trắc nghiệm
Lớp 7Lớp 7 - kết nối tri thức
Lớp 7 - Chân trời sáng sủa tạo
Lớp 7 - Cánh diều
Sách/Vở bài tập
Đề thi
Chuyên đề và Trắc nghiệm
Lớp 8Sách giáo khoa
Sách/Vở bài tập
Đề thi
Chuyên đề & Trắc nghiệm
Lớp 9Sách giáo khoa
Sách/Vở bài xích tập
Đề thi
Chuyên đề & Trắc nghiệm
Lớp 10Lớp 10 - kết nối tri thức
Lớp 10 - Chân trời sáng tạo
Lớp 10 - Cánh diều
Sách/Vở bài bác tập
Đề thi
Chuyên đề và Trắc nghiệm
Lớp 11Sách giáo khoa
Sách/Vở bài bác tập
Đề thi
Chuyên đề và Trắc nghiệm
Lớp 12Sách giáo khoa
Sách/Vở bài xích tập
Đề thi
Chuyên đề & Trắc nghiệm
ITNgữ pháp tiếng Anh
Lập trình Java
Phát triển web
Lập trình C, C++, Python
Cơ sở dữ liệu

Bộ đề thi hóa học 10Bộ đề thi chất hóa học lớp 10 - liên kết tri thức
Bộ đề thi chất hóa học lớp 10 - Cánh diều
Bộ đề thi hóa học lớp 10 - Chân trời sáng tạo
Đề kiểm tra 15 phút chất hóa học 10 học kì 1 có đáp án (Bài số 1)(4 đề)
Trang trước
Trang sau
Đề đánh giá 15 phút hóa học 10 học kì 1 tất cả đáp án (Bài số 1)(4 đề)
Dưới đấy là danh sách Đề kiểm tra 15 phút chất hóa học 10 học kì 1 bao gồm đáp án (Bài số 1)(4 đề). Hi vọng bộ đề thi này để giúp bạn ôn luyện và đạt điểm cao trong các bài thi môn hóa học lớp 10.
Bài giảng: Đề chất vấn 15 phút hóa học 10 học tập kì 1 gồm đáp án (Lần 1 - tự luận) - Cô Phạm Thu Huyền (Giáo viên Viet
Jack)
Đề bình chọn 15 phút hóa học 10 học kì 1 có đáp án (Bài số 1)(4 đề)
Phòng giáo dục và đào tạo và Đào tạo .....
Đề chất vấn 15 phút học tập kì 1
Môn: hóa học 10
Thời gian làm cho bài: 15 phút
(Đề 1)
Bài giảng: Đề kiểm tra 15 phút chất hóa học 10 học kì 1 có đáp án (Lần 1 - Trắc nghiệm) - Cô Phạm Thu Huyền (Giáo viên Viet
Jack)
Câu 1. đánh giá nào dưới đây đúng khi nói đến 3 nguyên tử:
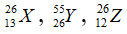
A. X với Z bao gồm cùng số khối.
B. X, Z là 2 đồng vị của và một nguyên tố hoá học.
C. X, Y thuộc cùng một nguyên tố hoá học.
D. X với Y tất cả cùng số nơtron.
Câu 2. Một nguyên tử của yếu tố X tất cả tổng số phân tử proton, nơtron, electron là 52 và tất cả số khối là 35. Số hiệu nguyên tử của yếu tố X là
A. 18. B. 23. C. 17. D. 15.
Câu 3. Cho cấu hình electron của ion X2+ là 1s22s22p63s23p63d6. Trong bảng tuần hoàn các nguyên tố hoá học, thành phần X thuộc
A. Chu kì 4, team VIIIB. B. Chu kì 4, team VIIIA.
C. Chu kì 3, team VIB. D. Chu kì 4, team IIA.
Câu 4. Dãy các nguyên tố thu xếp theo chiều tăng cao tính phi kim trường đoản cú trái sang đề nghị là
A. N, P, O, F. B. P, N, F, O.
C. N, P, F, O. D. P, N, O, F.
Câu 5. Nguyên tử của yếu tố X có thông số kỹ thuật electron phần bên ngoài cùng là ns2np4. Vào hợp chất khí của yếu tố X cùng với hiđro, X chiếm phần 94,12% khối lượng. Phần trăm trọng lượng của yếu tắc X trong oxit tối đa là
A. 27,27%. B. 40,00%. C. 60,00%. D. 50,00%.
Câu 6. phạt biểu làm sao sau đấy là sai?
A. Nguyên tử sắt kẽm kim loại thường có 1, 2 hoặc 3 electron ở phần bên ngoài cùng.
B. Những nhóm A bao hàm các yếu tố s với nguyên tố p.
C. Vào một chu kì, bán kính nguyên tử kim loại nhỏ tuổi hơn bán kính nguyên tử phi kim.
D. Những kim loại thường có ánh kim do những electron thoải mái phản xạ tia nắng nhìn thấy được
Câu 7. Nguyên tử X và Y tất cả hiệu số nguyên tử lần lượt là 19 cùng 15. Dấn xét nào dưới đây đúng?
A. X và Y hồ hết là phi kim.
B. X là một phi kim còn Y là một kim loại.
C. X là sắt kẽm kim loại còn Y là phi kim.
D. X và Y rất nhiều là kim loại
Câu 8. tuyên bố sau đó là sai?
A. Số yếu tắc trong chu kì 2 với 3 theo thứ tự là 8 với 18.
B. Bảng tuần hoàn bao gồm 8 team A cùng 8 nhóm B.
C. Những nhóm A bao hàm các thành phần s và nguyên tố p
D. Bảng tuần hoàn có có những ô nguyên tố, các chu kì và những nhóm.
Câu 9. những hạt cấu trúc nên nguyên tử là
A. Electron, proton.
C. Nơtron, electron.
B. Proton, nơtron.
D. Electron, proton, nơtron.
Câu 10. Số electron buổi tối đa phân bổ trên lớp thứ 3 vào vỏ nguyên tử là
A. 16.B. 32.C. 50.D. 18.
Hướng dẫn giải:
Câu 1. lựa chọn A
A đúng vị X và Z tất cả cùng số khối là 26
B sai vày X cùng Z tất cả số proton không giống nhau nên chưa hẳn là đồng vị của và một nguyên tố.
C sai vì chưng X là nhôm còn Y là sắt.
D sai bởi vì X gồm 13 nơtron còn Y có 29 nơtron.
Câu 2. chọn C
Gọi số phân tử proton, nơtron, electron trong X lần lượt là p, n, e.
Ta có:
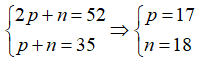
Vậy số hiệu nhân tố của X là 17.
Câu 3. lựa chọn A
Cấu hình electron của X là 1s22s22p63s23p63d64s2
Vậy X ở chu kỳ 4 do gồm 4 lớp electron, team VIIIB do tất cả 8 electron hóa trị, yếu tố d.
Câu 4. lựa chọn D
F tất cả tính phi kim mạnh mẽ nhất → nhiều loại B với C.
N và p thuộc cùng một nhóm, z
N p nên tính phi kim của N > p. → một số loại A.
Câu 5. lựa chọn B
Công thức hợp chất khí là XH2
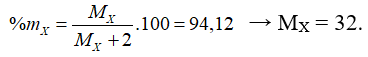
Xem thêm: Hết băng vệ sinh phải làm sao ? hết băng vệ sinh phải làm sao
Công thức oxit cao nhất là SO3
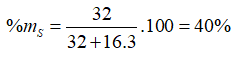
Câu 6. lựa chọn C
C sai vì trong một chu kỳ luân hồi , bán kính nguyên tử kim loại to hơn bán kính nguyên tử phi kim.
Câu 7. chọn C
Cấu hình electron nguyên tử của X là 1s22s22p63s23p64s1
→ X là sắt kẽm kim loại vì gồm 1e ở lớp ngoài cùng.
Cấu hình electron nguyên tử của Y là 1s22s22p63s23p3
→ Y là phi kim vì gồm 5e ở phần ngoài cùng.
Câu 8. chọn A
A sai vị Số yếu tắc trong chu kì 2 cùng 3 đông đảo là 8.
Câu 9. chọn D
Các hạt cấu tạo nên nguyên tử là electron, proton, nơtron.
Câu 10. lựa chọn D
Số electron tôí nhiều trên lớp thứ 3 là 2.32 = 18.
Phòng giáo dục đào tạo và Đào chế tạo .....
Đề đánh giá 15 phút học kì 1
Môn: hóa học 10
Thời gian làm bài: 15 phút
(Đề 2)
Bài giảng: Đề soát sổ 15 phút chất hóa học 10 học tập kì 1 tất cả đáp án (Lần 1 - Trắc nghiệm) - Cô Phạm Thu Huyền (Giáo viên Viet
Jack)
Câu 1. vào nguyên tử, hạt không với điện là
A. Nơtron với proton. B. Proton.C. Electron.D. Nơtron.
Câu 2. Ion tất cả 18 electron và 16 proton với điện tích là
A. 16+.B. 2−. C. 18−.D. 2+.
Câu 3. Tổng số hạt p, n, e vào nguyên tử
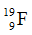
A. 19. B. 28. C. 30. D. 32.
Câu 4. Cho cấu hình electron nguyên tử các nguyên tố sau
a) 1s22s1 b) 1s22s22p5 c) 1s22s22p63s23p1
d) 1s22s22p63s2 e) 1s22s22p63s23p4
Cấu hình của những nguyên tố phi kim là
A. A, b. B. B, c. C. C, d. D. B, e.
Câu 5. Nguyên tử khối trung bình của đồng là 63,546. Đồng lâu dài trong trường đoản cú nhiên
với 2 đồng vị là 63Cu với 65Cu. Thành phần trăm theo số nguyên tử của 65Cu là
A. 23,7%. B. 76,3%. C. 72,7%. D. 27,3%.
Câu 6. Nguyên tử nguyên tố X tất cả tổng số hạt bởi 82, hạt mang điện nhiều hơn hạt không có điện là 22 hạt. Số khối A của nguyên tử X là
A. 52. B. 48. C. 56. D. 54.
Câu 7. Số thành phần thuộc chu kỳ 3 là
A. 8. B. 18. C. 32. D. 50.
Câu 8. cho nguyên tố X gồm số hiệu nguyên tử là 17, địa điểm của yếu tắc X vào bảng tuần hoàn những nguyên tố hoá học là
A. Ô số 17, chu kì 3, nhóm VIIA. B. Ô số 17, chu kì 3, nhóm IA.
C. Ô số 17, chu kì 4, đội IIA. D. Ô số 17, chu kì 3, nhóm IIA.
Câu 9. Theo quy luật biến đổi tính chất đơn chất của các nguyên tố vào bảng tuần trả thì
A. Phi kim mạnh nhất là iot.
B. Kim loại mạnh nhất là liti.
C. Phi kim vượt trội nhất là flo.
D. Kim loại yếu nhất là xesi.
Câu 10. nguyên tố R ở trong chu kì 3, nhóm VIIA vào bảng tuần hoàn. Bí quyết oxit tối đa của R là
A. RO3. B. R2O7. C. R2O3. D. R2O.
Hướng dẫn giải:
Câu 1. DTrong nguyên tử phân tử không mang điện là nơtron.
Câu 2. B
Hạt electron nhiều hơn thế nữa hạt proton là 2 hạt. Vậy electron với điện tích 2-.
Câu 3. B
Số hạt p = e = 9, số n = A-p = 19 – 9 = 10.
Tổng số hạt phường + n + e = 9 + 9 + 10 = 28.
Câu 4. D
Nguyên tử bao gồm 5, 6, 7 electron lớp ngoài cùng thường là nguyên tử của nhân tố phi kim.
a) 1e phần ngoài cùng
b) 7e lớp bên ngoài cùng
c) 3e lớp bên ngoài cùng
d) 2e lớp bên ngoài cùng
e) 6e phần bên ngoài cùng
Vậy b với e là thông số kỹ thuật electron nguyên tử của những nguyên tố phi kim.
Câu 5. D
Ta có, gọi % của đồng vị 63Cu = x, thì % đồng vị 65Cu = 100-x
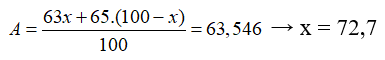
Vậy %65Cu là 27,3%.
Câu 6. C
Gọi số phân tử proton, nơtron cùng electron vào X lần lượt là p, n và e.
Tổng số phân tử proton, nơtron cùng electron trong 1 nguyên tử nguyên tố X là 82:
p + e + n = 82 giỏi 2p + n = 82 (do phường = e) (1)
Số hạt có điện (p và e) nhiều hơn nữa số phân tử không sở hữu điện (n) là 22 hạt:
(p+e) – n = 22 xuất xắc 2p – n = 22 (2)
Giải (1), (2) ta có phường = e = 26; n = 30
Số khối của X là A = z + n = p + n = 56.
Câu 7. A
Các chu kì 3 là chu kì nhỏ, có 8 yếu tắc trong chu kì 3.
Câu 8. A
Cấu hình electron nguyên tử X :
X trực thuộc ô 17 do gồm z = 17, chu kỳ 3 do có 3 lớp electron, đội VIIA bởi 7 electron phần ngoài cùng, thành phần p.
Câu 9. C
Theo quy luật thay đổi tính chất đơn chất của các nguyên tố vào bảng tuần trả thì vào một chu kỳ những nguyên tố thuộc đội VIIA tất cả tính phi kim dạn dĩ nhất. Xét trong team VIIA thì nguyên tố dẫn đầu nhóm sẽ sở hữu tính phi kim khỏe mạnh nhất. Vậy Flo gồm tính phi kim táo bạo nhất.
Câu 10. B
R thuộc team VIIA nên bao gồm 7e lớp bên ngoài cùng. Trong công thức oxit cao nhất của R, R bao gồm hóa trị VII.
Vậy bí quyết oxit tối đa của R là R2O7.
Phòng giáo dục và Đào chế tạo .....
Đề kiểm tra 15 phút học tập kì 1
Môn: hóa học 10
Thời gian có tác dụng bài: 15 phút
(Đề 3)
Bài giảng: Đề kiểm tra 15 phút hóa học 10 học tập kì 1 tất cả đáp án (Lần 1 - Trắc nghiệm) - Cô Phạm Thu Huyền (Giáo viên Viet
Jack)
Câu 1. Chọn lời giải đúng: các hạt cấu tạo nên hạt nhân của phần nhiều nguyên tử là
A. Proton với nơtron. B. Electron với proton.
C. Electron , proton với nơtron. D. Nơtron và electron.
Câu 2. Tổng số phân tử proton, nơtron cùng electron trong 1 nguyên tử yếu tố X là
155, trong số đó số hạt có điện nhiều hơn số phân tử không với điện là 33 hạt. X là nguyên tố nào dưới đây?
A. 29Cu.B. 47Ag. C. 26Fe. D. 13Al.
Câu 3. Kí hiệu nguyên tử biểu lộ đầy đủ đặc thù cho một nguyên tử của một yếu tố hoá học vày nó cho biết
A. Số khối A. B. Số hiệu nguyên tử Z.
C. Nguyên tử khối của nguyên tử. D. Số khối A với số hiệu nguyên tử Z.
Câu 4. những ion với nguyên tử: Ne, Na+, F− tất cả điểm thông thường là
A. Bao gồm cùng số khối.B. Gồm cùng số electron.
C. Tất cả cùng số proton. D. Tất cả cùng số nơtron.
Câu 5. Số proton, số electron, số notron trong ion
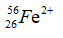
A. 26, 26, 30. B. 26, 28, 30.
C. 26, 28, 30. D. 26, 24, 30.
Câu 6. Nitơ trong vạn vật thiên nhiên là láo lếu hợp có hai đồng vị bao gồm % về số nguyên tử tương ứng là
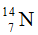
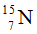
A. 14,7.B. 14,0.C. 14,4.D. 13,7.
Câu 7. yếu tố Z thuộc nhóm A của bảng tuần hoàn. Oxit ứng cùng với hóa trị cao nhất của Z gồm công thức hóa học ZO3. Phương pháp hợp hóa học khí của Z cùng với H là
A. ZH2. B. ZH6. C. ZH3. D. ZH4.
Câu 8. Oxit tối đa của thành phần R thuộc đội VIA tất cả 60% oxi về khối lượng. Yếu tố R và công thức oxit cao nhất là
A. SO2. B. SO3. C. PO3. D. Se
O3.
Câu 9. nhị nguyên tố X,Y đứng tiếp đến nhau trong một chu kì trực thuộc bảng tuần hoàn bao gồm tổng điện tích dương trong phân tử nhân là 25. địa chỉ của X cùng Y vào bảng tuần trả là (biết Zx y)
A. X chu kì 3, nhóm IIA, Y chu kì 2, team IIIA.
B. X chu kì 3, nhóm IIA, Y chu kì 3, team IIIA.
C. X chu kì 2, đội IIIA, Y chu kì 3 đội IIIA.
D. Toàn bộ đều sai.
Câu 10. vào bảng tuần hoàn những nguyên tố được bố trí theo chính sách nào?
A. Theo chiều tăng của điện tích hạt nhân.
B. Các nguyên tố gồm cùng số lớp electron trong nguyên tử được xếp thành 1 hàng.
C. Các nguyên tố gồm cùng số electron hoá trị trong nguyên tử được xếp thành 1 cột.
D. Cả A, B, C.
Hướng dẫn giải:
Câu 1. A
Hạt nhân của các nguyên tử hầu như được cấu trúc nên từ hai các loại hạt: Proton và nơtron (trừ nguyên tử Hidro).
Câu 2. B
Gọi số hạt proton, nơtron với electron theo lần lượt là p, n và e.
Tổng số hạt proton, nơtron cùng electron trong 1 nguyên tử nhân tố X là 155:
p + e + n = 155 hay 2p + n = 155 (do p. = e) (1)
Số hạt với điện (p cùng e) nhiều hơn nữa số phân tử không sở hữu điện (n) là 33 hạt
(p+e) – n = 33 giỏi 2p – n = 33 (2)
Giải (1), (2) ta có phường = e = 47. Vậy X là Ag.
Câu 3. D
Kí hiệu nguyên tử cho biết thêm số khối A cùng số hiệu nguyên tử Z.
Câu 4. B
Cấu hình electron của Ne, Na+, F- : 1s22s22p6
Vậy các ion và nguyên tử này còn có cùng số electron.
Câu 5. D
Fe2+ có số p = 26, Số n = A – z = 56 – 26 = 30.
Số e = 26 – 2 = 24.
Câu 6. B
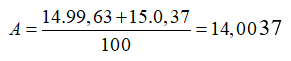
Câu 7. A
Hóa trị của Z trong oxit cao nhất là VI, đề xuất hóa trị của Z trong hợp hóa học khí cùng với H là II. Cách làm hợp hóa học khí của Z cùng với H là ZH2.
Câu 8. B
R thuộc nhóm VIA đề xuất oxit tối đa là RO3
Theo bài xích ta có:
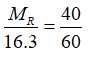
→ MR= 32. Vậy R là lưu hoàng (S). Bí quyết oxit tối đa là : SO3.
Câu 9. B
Theo bài xích ra Zx + 1 = ZY và ZX + Zy= 25 . Vậy Zx = 12 và Zy = 13.
Cấu hình electron của X là 1s22s22p63s2 ,X sống chu kì 3, team IIA.
Cấu hình electron của Y là 1s22s22p63s23p1 ,Y ngơi nghỉ chu kì 3 đội IIIA
Câu 10. D
Phòng giáo dục và Đào chế tạo .....
Đề bình chọn 15 phút học kì 1
Môn: chất hóa học 10
Thời gian làm bài: 15 phút
(Đề 4)
Bài giảng: Đề bình chọn 15 phút hóa học 10 học kì 1 có đáp án (Lần 1 - Trắc nghiệm) - Cô Phạm Thu Huyền (Giáo viên Viet
Jack)
Câu 1. Tổng số hạt p, n, e trong nguyên tử
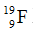
A. 19. B. 28. C. 30. D. 32.
Câu 2. phát biểu nào tiếp sau đây không đúng?
A. Số khối bởi tổng số phân tử proton với electron.
B. Số khối là số nguyên.
C. Số khối bởi tổng số phân tử proton với nơtron.
D. Số khối kí hiệu là A.
Câu 3. Phân lớp 3 chiều có số electron buổi tối đa là
A. 6.B. 18. C. 10. D. 14.
Câu 4. Trong thoải mái và tự nhiên cacbon có 2 đồng vị bền là
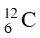
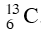
A. 98,9% cùng 1,1%. B. 49,5% và 51,5%.
C. 99,8% cùng 0,2%. D. 75% với 25%.
Câu 5. Tổng số phân tử proton (p), nơtron (n) cùng electron (e) vào nguyên tử của một nguyên tố là 21. Nhân tố là
A.
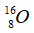
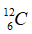
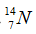
Câu 6. Trong thành phần của đa số nguyên tử độc nhất thiết đề xuất có các loại hạt nào dưới đây ?
A. Proton và nơtron. B. Proton và electron.
C. Nơtron cùng electron. D. Proton, nơtron, electron.
Câu 7. vào bảng tuần hoàn những nguyên tố, số chu kì nhỏ và số chu kì phệ là
A. 3 và 3. B. 4 với 3. C. 4 cùng 4. D. 3 và 4.
Câu 8. anion X2- có thông số kỹ thuật electron: 1s22s22p63s23p6. Nguyên tử yếu tắc X thuộc
A. Chu kỳ 3 team VIA.
B. Chu kỳ luân hồi 3 nhóm VIIIA.
C. Chu kỳ 4 team IIA.
D. Chu kỳ 4 nhóm VIA.
Câu 9. thành phần Z đứng sống ô máy 17 của bảng tuần hoàn. Có các phát biểu sau:
(1) Z tất cả độ âm năng lượng điện lớn.
(2) Z là 1 trong những phi kim mạnh.
(3) Z rất có thể tạo thành ion bền tất cả dạng Z+.
(4) Oxit tối đa của Z tất cả công thức chất hóa học Z2O5.
Trong các phát biểu trên, số tuyên bố đúng là
A. 1. B. 2. C. 3. D. 4.
Câu 10. các nguyên tố trong thuộc chu kì có cùng
A. Số electron lớp ngoài cùng.
B. Khối lượng nguyên tử.
C. Điện tích phân tử nhân.
D. Số lớp electron.
Hướng dẫn giải:
Câu 1. BSố hạt p. = e = 9, số n = A - z = A - phường = 19 – 9 = 10.
Tổng số hạt p + n + e = 28.
Câu 2. A
Số khối bởi tổng số hạt proton và nơtron.
Câu 3. C
Số electron tối đa trên phân lớp s là 2, phân lớp p. Là 6, phân lớp d là 10,phân lớp f là 14.
Câu 4. A
Gọi % số nguyên tử của đồng vị
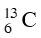
Ta bao gồm
Câu 5. C
Với các nguyên tử bền, ta bao gồm
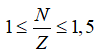
2p + n = 21 => n = 21 – 2p, cố vào (1) ta có
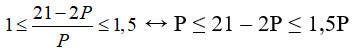
→ 6 ≤ phường ≤ 7.
Với p = 6 → n = 9 → A = 15 (không bao gồm đáp án phù hợp).
Với p. = 7 → n = 7 → A = 14 (đáp án C).
Câu 6. B
Nguyên tử trung hòa - nhân chính về điện bắt buộc thành phần nguyên tử độc nhất thiết phải bao gồm cả proton cùng electron.
Nguyên tử hiđro không có hạt nơtron.
Câu 7. D
Bảng tuần hoàn bao gồm 3 chu kỳ bé dại và 4 chu kỳ luân hồi lớn.
Câu 8. A
Cấu hình electron của X: 1s22s22p63s23p4
X nằm trong chu kì 3 (3 lớp electron), đội VIA (6 electron lớp bên ngoài cùng, yếu tắc p).
Câu 9. B
Cấu hình electron nguyên tử của Z là: 1s22s22p63s23p5
Vậy Z thuộc đội VIIA → Z có độ âm điện lớn, là phi kim mạnh.
Z hoàn toàn có thể nhận 1 electron sinh sản thành ion Z-, oxit tối đa của Z tất cả công thức là Z2O7.
Câu 10. D
Các nguyên tố trong cùng chu kì tất cả cùng số lớp electron.
CHỈ TỪ 250K 1 BỘ TÀI LIỆU GIÁO ÁN, ĐỀ THI, KHÓA HỌC BẤT KÌ, canthiepsomtw.edu.vn HỖ TRỢ DỊCH COVID
Bộ giáo án, đề thi, bài xích giảng powerpoint, khóa học giành cho các thầy cô và học viên lớp 10, đẩy đủ các bộ sách cánh diều, liên kết tri thức, chân trời trí tuệ sáng tạo tại https://tailieugiaovien.com.vn/ . Hỗ trợ zalo Viet
Jack Official








