+ x, y, z,… là những số nguyên, là chỉ số nguyên tử của nhân tố trong một phân tử thích hợp chất.
Bạn đang xem: Top 33+ công thức hóa học lớp 8
*Lưu ý: Ca
CO3 thì CO3 là đội nguyên tử.
Ví dụ:
- CTHH của nước là: H2O
- CTHH của muối nạp năng lượng là: Na
Cl
- CTHH của khí cacbonic là: CO2
III. Ý NGHĨA CỦA CÔNG THỨC HÓA HỌC
Mỗi cách làm hóa học chỉ 1 phân tử của chất, mang đến biết
- yếu tắc nào tạo ra chất
- Số nguyên tử của từng nguyên tố trong 1 phân tử chất
- Phân tử khối của chất
Ví dụ: Từ cách làm hóa học của N2, ta biết được:
- Đơn hóa học được tạo bởi vì nguyên tố Nitơ
- bao gồm 2 nguyên tử Nitơ tạo thành thành phân tử
- Phân tử khối = 14.2 = 28 đv
C
Ví dụ:+ 2Cl: 2 nguyên tử clo+ Cl2: 1 phân tử Cl2+ 3H2O: 3 phân tử H2O.+ Năm nguyên tử đồng: 5Cu+ Bốn phân tử khí hiđro: 4H2+ Năm phân tử kali sunfat (2K, 1S, 4O): 5K2SO4
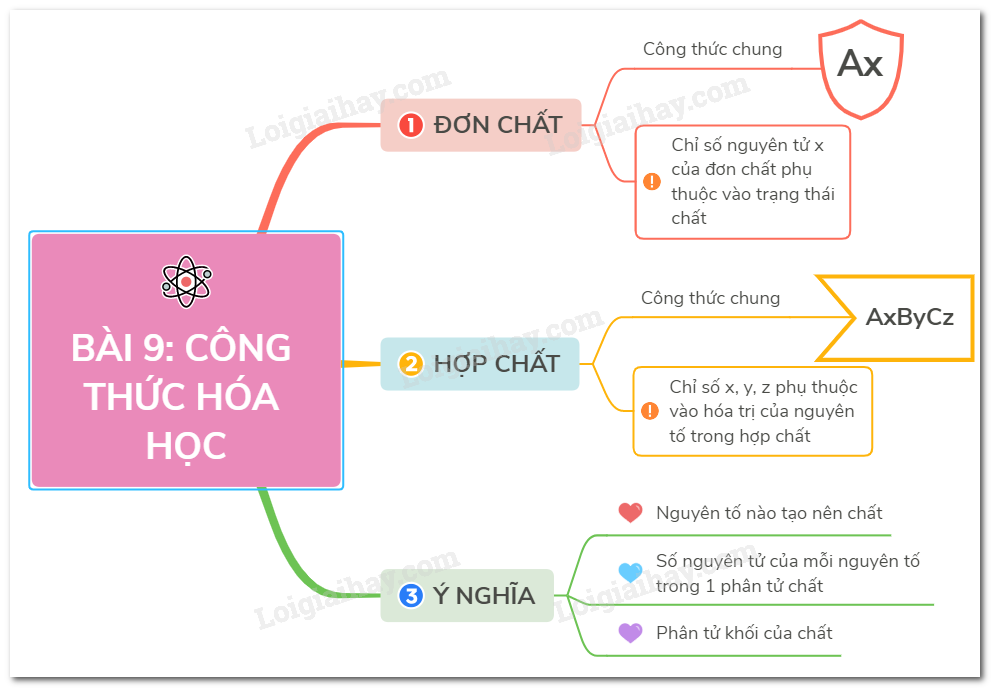
Sơ đồ tứ duy: phương pháp hóa học


Bài tiếp theo

 |  |  |  |
 |  |  |  |


Vấn đề em chạm chán phải là gì ?
Sai chính tả
Giải khó khăn hiểu
Giải sai
Lỗi không giống
Hãy viết cụ thể giúp Loigiaihay.com
Cảm ơn các bạn đã sử dụng Loigiaihay.com. Đội ngũ giáo viên cần nâng cấp điều gì để các bạn cho bài viết này 5* vậy?
Vui lòng để lại tin tức để ad rất có thể liên hệ với em nhé!
Đăng cam kết để nhận giải thuật hay và tài liệu miễn phí
Cho phép loigiaihay.com nhờ cất hộ các thông báo đến bạn để nhận được các lời giải hay cũng giống như tài liệu miễn phí.
Vn
Doc soạn nội dung Tổng hợp bí quyết Hóa học tập 8 nên nhớ, gồm tất cả Công thức hóa học lớp 8 bao gồm trong chương trình, ngoài ra có mở rộng cải thiện một số công thức ở lớp trên. Tiếp sau đây mời các bạn tham khảo.
A. Một trong những tài liệu nội dung chương trình chất hóa học mới
(Theo công tác Hóa học tập mới, tên nguyên tố, cũng nhưng những hợp hóa học vô cơ sẽ được gọi theo danh pháp Quốc tế)
B. CÁC CÔNG THỨC HÓA HỌC LỚP 8 CẦN NHỚ
Bản quyền ở trong về Vn
Doc nghiêm cấm hầu như hành vi xào luộc vì mục đích thương mại
I. Phương pháp tính nguyên tử khối
NTK của A = khối lượng của nguyên tử A tính bằng gam : cân nặng của 1 đv
C tính ra gam
Ví dụ:
NTK của oxi =

II. Định luật pháp bảo toàn khối lượng
Cho phản bội ứng: A + B → C + D
Áp dụng định quy định BTKL:
m
A + m
B = m
C + m
D
III. Tính hiệu suất phản ứng
Dựa vào 1 trong các chất thâm nhập phản ứng:
H% = (Lượng thực tiễn đã dùng phản ứng : Lượng tổng số đã lấy) x 100%
Dựa vào 1 trong những chất sản xuất thành
H% = (Lượng thực tiễn thu được: Lượng thu theo lí thuyết) x 100%
IV. Bí quyết tính số mol
n = Số hạt vi mô : N
N là hằng số Avogrado: 6,023.1023



Trong đó:
P: áp suất (atm)
R: hằng số (22,4 : 273)
T: nhiệt độ: o
K (o
C + 273)
V. Bí quyết tính tỉ khối
Công thức tính tỉ khối của khí A với khí B:

- công thức tính tỉ khối của khí A đối với không khí:

Trong đó D là cân nặng riêng: D(g/cm3) tất cả m (g) và V (cm3) giỏi ml
VI. Bí quyết tính thể tích
Thể tích chất khí làm việc đktc
V = n x 22,4
- Thể tích của hóa học rắn và hóa học lỏng

- Thể tích ở đk không tiêu chuẩn

P: áp suất (atm)
R: hằng số (22,4 : 273)
T: nhiệt độ: o
K (o
C+ 273)
VII. Tính thành phần phần trăm về cân nặng của mỗi ngyên tố trong thích hợp chất
VD: Ax
By ta tính %A, %B

VIII. độ đậm đặc phần trăm

Trong đó: mct là khối lượng chất tan
mdd là trọng lượng dung dịch

Trong đó: centimet nồng độ mol (mol/lit)
D trọng lượng riêng (g/ml)
M trọng lượng mol (g/mol)
IX. Mật độ mol

Trong đó : n
A là số mol
V là thể tích

C%: mật độ mol
D: trọng lượng riêng (g/ml)
M: trọng lượng mol (g/mol)
X. Độ tan

D. CÁC DẠNG BÀI TẬP HÓA 8
I. Cách làm hóa học với tính theo bí quyết hóa học
1. Lập phương pháp hóa học tập của hòa hợp chất lúc biết hóa trị
Các bước để khẳng định hóa trị
Bước 1: Viết bí quyết dạng Ax
By
Bước 2: Đặt đẳng thức: x hóa trị của A = y × hóa trị của B
Bước 3: thay đổi thành tỉ lệ:

Chọn a’, b’ là hầu hết số nguyên dương cùng tỉ lệ b’/a’ là về tối giản => x = b (hoặc b’); y = a (hoặc a’)
2. Tính nhân tố % theo khối lượng của những nguyên tố vào hợp chất Ax
By
Cz
Cách 1.
+ Tìm cân nặng mol của đúng theo chất
+ tìm số mol nguyên tử mỗi nguyên tố trong 1 mol hợp hóa học rồi quy về khối lượng
+ search thành phần tỷ lệ các nhân tố trong hòa hợp chất
Cách 2. Xét phương pháp hóa học: Ax
By
Cz

Hoặc %C = 100% - (%A + %B)
3. Lập bí quyết hóa học tập của hợp chất khi biết thành phần phần trăm (%) về khối lượng
Các bước xác minh công thức hóa học của vừa lòng chất
+ bước 1: Tìm trọng lượng của mỗi nguyên tố có trong một mol vừa lòng chất.
+ bước 2: tìm kiếm số mol nguyên tử của yếu tố có trong một mol hợp chất.
+ bước 3: Lập công thức hóa học tập của vừa lòng chất.

4. Lập phương pháp hóa học phụ thuộc tỉ lệ khối lượng của những nguyên tố.
a. Bài tập tổng quát: cho một hợp chất có 2 thành phần A cùng B tất cả tỉ lệ về khối lượng là a:b giỏi

b. Phương pháp giải
Gọi phương pháp hóa học tổng quát của 2 nguyên tố bao gồm dạng là Ax
By. (Ở đây bọn họ phải đi tìm kiếm được x, y của A, B. Tìm kiếm tỉ lệ: x:y => x, y)

=> CTHH
II. Phương trình hóa học. Tính theo phương trình hóa học.
1. Phương trình hóa học
a. Cân bằng phương trình hóa học
a) Cu
O + H2 → Cu + H2O
b) CO2 + Na
OH → Na2CO3 + H2O
c) Zn + HCl → Zn
Cl2 + H2
d) Al + O2 → Al2O3
e) Na
OH + Cu
SO4 → Cu(OH)2 + Na2SO4
f) Al2O3 + Na
OH → Na
Al
O2 + H2O
g) Fe(OH)3 → Fe2O3 + H2O
h) H3PO4 + Ca(OH)2 → Ca3(PO4)2 + H2O
i) Ba
Cl2 + Ag
NO3 → Ag
Cl + Ba(NO3)2
k) Fe
O + H2SO4 → Fe2(SO4)3 + SO2 + H2O
Đáp án gợi ý giải bỏ ra tiết
a) Cu
O + H2 → Cu + H2O
b) CO2 + 2Na
OH → Na2CO3 + H2O
c) Zn + 2HCl → Zn
Cl2 + H2
d) 4Al + 3O2 → 2Al2O3
e) 2Na
OH + Cu
SO4 → Cu(OH)2 + Na2SO4
f) Al2O3 + 2Na
OH → 2Na
Al
O2 + H2O
g) 2Fe(OH)3 → Fe2O3 +3 H2O
h) 2H3PO4 + 3Ca(OH)2 → Ca3(PO4)2 + 3H2O
i) Ba
Cl2 + 2Ag
NO3 → 2Ag
Cl + Ba(NO3)2
k) 2Fe
O + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O
b. Xong xuôi các phương trình hóa học sau:
1) Photpho + khí oxi → Photpho(V) oxit (P2O5)
2) Khí hiđro + oxit fe từ (Fe3O4) → fe + Nước
3) Kẽm + axit clohidric → kẽm clorua + hidro
4) can xi cacbonat + axit clohidric → can xi clorua + nước + khí cacbonic
5) sắt + đồng (II) sunfat → sắt (II) sunfat + đồng
Đáp án trả lời giải
1) Photpho + khí oxi → Photpho(V) oxit (P2O5)
2P + 5O2 → P2O5
2) Khí hiđro + oxit sắt từ (Fe3O4) → fe + Nước
4H2 + Fe3O4 → 3Fe + 4H2O
3) Kẽm + axit clohidric → kẽm clorua + hidro
Zn + 2HCl → Zn
Cl2 + H2
4) can xi cacbonat + axit clohidric → can xi clorua + nước + khí cacbonic
Ca
CO3 + 2HCl → Ca
Cl2 + H2O + CO2
5) sắt + đồng (II) sunfat → fe (II) sunfat + đồng
Fe + Cu
SO4 → Fe
SO4 + Cu
c. Chọn CTHH thích hợp đặt vào phần lớn chỗ có dấu chấm hỏi và cân bằng các phương trình hóa học sau:
1) Ca
O + HCl → ? + H2
2) p. + ? → P2O5
3) Na2O + H2O →?
4) Ba(NO3)2 + H2SO4 → Ba
SO4 + ?
5) Ca(HCO3)2 → Ca
CO3 + CO2 + ?
6) Ca
CO3 + HCl → Ca
Cl2 + ? + H2O
7) Na
OH + ? → Na2CO3 + H2O
Đáp án giải đáp giải
1) Ca
O + 2HCl → Ca
Cl2+ H2
2) 4P + 5O2 → 2P2O5
3) Na2O + H2O → 2Na
OH
4) Ba(NO3)2 + H2SO4 → Ba
SO4 + 2HNO3
5) Ca(HCO3)2 → Ca
CO3 + CO2 + H2O
6) Ca
CO3 + 2HCl → Ca
Cl2 + CO2 + H2O
7) 2Na
OH + CO2 → Na2CO3 + H2O
d. Cân bằng các phương trình chất hóa học sau cất ẩn
1) Fex
Oy + H2 → fe + H2O
2) Fex
Oy + HCl → Fe
Cl2y/x + H2O
3) Fex
Oy + H2SO4 → Fe2(SO4)2y/x + H2O
4) M + H2SO4 → M2(SO4)n + SO2 + H2O
5) M + HNO3 → M(NO3)n + NO + H2O
6) Fex
Oy + H2SO4 → Fe2(SO4)2y/x + SO2 + H2O
Đáp án khuyên bảo giải
1) Fex
Oy + H2 → sắt + H2O
2) Fex
Oy + 2y HCl→ x Fe
Cl2y/x + y H2O
3) 2Fex
Oy + (6x - 2y) H2SO4 → x
Fe2(SO4)3 + (3x - 2y) SO2 + (6x - 2y) H2O
4) 2Fex
Oy + (6x - 2y) H2SO4 → x
Fe2(SO4)3 + (3x - 2y) SO2 + (6x - 2y) H2O
5) (5x - 2y) M + (6nx - 2ny) HNO3 → (5x - 2y)M(NO3)n + n
Nx
Oy + (3nx - ny)H2O
6) Fex
Oy + 2y H2SO4 → x Fe2(SO4)2y/x + 2y H2O
2. Tính theo phương trình hóa học
Các công thức đo lường và thống kê hóa học buộc phải nhớ
)

Trong đó:
n: số mol của hóa học (mol)
m: cân nặng (gam)
M: trọng lượng mol (gam/mol)
=>
)
)
V: thề tích hóa học (đktc) (lít)
3. Việc về lượng chất dư
Giả sử gồm phản ứng hóa học: a
A + b
B ------- > c
C + d
D.
Cho n
A là số mol hóa học A, và n
B là số mol chất B




Zn + 2HCl → Zn
Cl2 + H2
Theo phương trình: 1 mol 2 mol 1 mol
Theo đầu bài xích : 0,1 mol 0,1 mol 0,05 mol
Xét tỉ lệ:


Ví dụ 2: Cho 13 gam Kẽm công dụng vứi 24,5 gam H2SO4, sau bội phản ứng thu được muối Zn
SO4, khí hidro (đktc) và chất còn dư
a) Viết phương trình phản nghịch ứng hóa học
b) Tính thể tích (đktc) khí hidro sinh ra.
c) Tính trọng lượng các chất sót lại sau phản ứng
Đáp án gợi ý giải bỏ ra tiết
a) Phương trình phản ứng hóa học:
Zn + H2SO4 (loãng) → Zn
SO4 + H2
b) n
Zn = 0,2 mol
n
H2SO4= 0,25 mol
Phương trình phản bội ứng hóa học:
Zn + H2SO4 (loãng) → Zn
SO4 + H2
Theo phương trình: 1 mol 1 mol 1 mol
Theo đầu bài: 0,2 mol 0,25 mol
Xét tỉ lệ:
Zn làm phản ứng hết, H2SO4 dư, bội phản ứng tính theo số mol Zn
Số mol của khí H2 phản bội ứng là: n
Zn = n
H2 = 0,2 mol
Thể tích khí H2 bằng: VH2 = 0,2 . 22,4 = 4,48 lít
c) hóa học còn lượng sau phản ứng là Zn
SO4 và H2SO4 dư
Số mol của Zn
SO4 bằng: n
Zn
SO4 = n
Zn = 0,2 mol
Khối lượng của Zn
SO4 bằng: m
Zn
SO4 = 0,2 . 161 = 32,2 gam
Số mol của H2SO4 dư = Số mol của H2SO4 ban sơ - Số mol của H2SO4 bội phản ứng = 0,25 - 0,2 = 0,05 mol
Khối lương H2SO4 dư = 0,05 . 98 = 4,9 gam
III. Dung dịch cùng nồng độ dung dịch
1. Các công thức yêu cầu ghi nhớ
a. Độ tan

b. Nồng độ phần trăm dung dịch (C%)

Trong đó:
mct: khối lượng chất tan (gam)
mdd: khối lượng dung dịch (gam)
Ví dụ: phối hợp 15 gam muối hạt vào 50 gam nước. Tình nồng độ tỷ lệ của dung dịch thu được:
Đáp án lí giải giải
Ta có: mdd = mdm + mct = 50 + 15 = 65 gam
Áp dụng công thức:


c. Nồng độ mol hỗn hợp (CM)

Ví dụ: Tính độ đậm đặc mol của dung dịch khi 0,5 lit dung dịch Cu
SO4 chứa 100 gam Cu
SO4
Đáp án lý giải giải
Số mol của Cu
SO4 = 100 : 160 = 0,625 mol
Nồng độ mol của dung dịch Cu
SO4 = 0,625 : 0,5 = 1,25M
d. Công thức liên hệ giữa D (khối lượng riêng), mdd (khối lượng dung dịch) và Vdd (thể tích dung dịch):

Dạng I: bài bác tập về độ tan
Bài tập số 1: Ở 20o
C, 60 gam KNO3 rã trong 190 nước thì thu được dung dịch bão hoà. Tính độ rã của KNO3 ở ánh sáng đó ?
Đáp án trả lời giải đưa ra tiết
Cứ 190 gam H2O tổ hợp hết 60 gam KNO3 chế tạo ra dung dịch bão hòa
100 gam H2O tổng hợp hết x gam KNO3
SKNO3 = (100.60)/190 = 31,58
Bài tập số 2: ngơi nghỉ 20o
C, độ chảy của K2SO4 là 11,1 gam. đề nghị hoà tan bao nhiêu gam muối bột này vào 80 gam nước thì thu được dung dịch bão hoà ở nhiệt độ đã cho?
Đáp án lí giải giải chi tiết
20o
C: 100g nước hòa tan tối đa 11,1g K2SO4
Vậy 80 gam nước hòa tan buổi tối đa là:
Số gam muối buộc phải hòa tan: (80.11,1)/100 = 8,88 gam
Bài tập số 3: Tính cân nặng KCl kết tinh đợc sau khi làm nguội 600 gam dung dịch bão hoà sống 80o
C xuống 20o
C. Biết độ tan S sống 80o
C là 51 gam, sinh sống 20o
C là 34 gam.
Xem thêm: Top 10 Loài Động Vật Nguy Hiểm Nhất Ẩn Náu Trong Khu Rừng Rậm Amazon
Đáp án hướng dẫn giải đưa ra tiết
Ở 80o
C, độ tung của KCl là 51 gam:
151 gam dung dịch bão hòa chứa 51 gam KCl
=> 604 gam → 204 gam
Đặt trọng lượng KCl tách ra là a gam
Ở 20o
C, độ tung của KCl là 34 gam:
134 gam hỗn hợp bão hòa cất 34 gam KCl
604 - a gam 204 - a gam
=> 34.(604 - a) = 134.(204 - a) => a = 68 gam
Vậy trọng lượng KCl kết tinh được là 68 gam.
Bài tập số 4: Biết độ rã S của Ag
NO3 nghỉ ngơi 60o
C là 525 gam, sinh hoạt 10o
C là 170 gam. Tính lượng Ag
NO3 tách bóc ra khi làm cho lạnh 2500 gam hỗn hợp Ag
NO3 bão hoà ngơi nghỉ 60o
C xuống 10o
C.
Đáp án lý giải giải đưa ra tiết
Độ tan của Ag
NO3 sinh sống 60o
C là 525 (g)
Ở 60o
C cứ 100g dung môi có 525 g Ag
NO3
⇒ Cứ 2500 - m
Ag
NO3 60o g dung môi gồm m
Ag
NO3 60o g Ag
NO3
Lập tỉ lệ:100/(2500−m
Ag
NO3) = 525/(m
Ag
NO3)
m
Ag
NO3 60o = 2100 (g) ⇒ mdm= 400(g)
Ở 10o
C cứ 100 g dung môi bao gồm 170g Ag
NO3
⇒Cứ 400 g dung môi có m
Ag
NO3 10o
C g Ag
NO3
Lập tỉ lệ: 100/400=170/m
Ag
NO3
⇒ m
Ag
NO3 10o
C = 680(g)
mtách ra = m
Ag
NO3 60o - m
Ag
NO3 10o
C = 2100 - 680 = 1420 (g)
Bài tập số 5: Hoà tan 120 gam KCl với 250 gam nớc ngơi nghỉ 50o
C (có độ chảy là 42,6 gam). Tính lượng muối còn thừa sau khoản thời gian tạo thành dung dịch bão hoà?
Đáp án khuyên bảo giải đưa ra tiết
Ở 50o
C có:
Cứ 100g nước hòa tan buổi tối đa 42,6 g KCl
Cứ 250g nước hòa tan tối đa x g KCl
=> x = (250.42,6)/100 = 106,5 g
Lượng muối hạt còn thừa sau khoản thời gian tạo thành dd bão hòa là:
mmuối còn quá = 120 - 106,5 = 13,5 (g)
Dạng II: pha trộn dung dịch xẩy ra phản ứng giữa những chất tan với nhau hoặc bội phản ứng giữa hóa học tan với dung môi → Ta yêu cầu tính độ đậm đặc của thành phầm (không tính độ đậm đặc của hóa học tan đó).
Ví dụ: Khi đến Na2O, Ca
O, SO3... Vào nước, xảy ra phản ứng:
Na2O + H2O → 2Na
OH
Ca
O + H2O → Ca(OH)2
Bài tập số 1: đến 6,2 gam Na2O vào 73,8 gam nước thu được dung dịch A. Tính độ đậm đặc của chất có trong hỗn hợp A?
Đáp án lí giải giải bỏ ra tiết
n
Na2O = 6,2/62 = 0,1 mol
Phương trình hóa học
Na2O + H2O → 2Na
OH
0,1 → 0,2 (mol)
m
Na
OH = 0,2.40 = 8 gam
mdd A = m
Na2O + mnước = 6,2 + 73,8 = 80 gam
-> C% Na
OH (dd A) = 8/80 .100% = 10%
Bài tập số 2: mang đến 6,2 gam Na2O vào 133,8 gam hỗn hợp Na
OH tất cả nồng độ 44,84%. Tính nồng độ tỷ lệ của chất gồm trong dung dịch?
Đáp án hướng dẫn giải bỏ ra tiết
n
Na2O = 6,2/62 = 0,1 mol
Phương trình hóa học
Na2O + H2O → 2Na
OH
⇒n
Na
OH tạo thành = 0,1.2 = 0,2 mol
n
Na
OH = (133,8.44,84)/(100.40) = 1,5 mol
⇒n
Na
OH = 1,5 + 0,2 = 1,7 mol
Bảo toàn khối lượng: m
Na2O + mdd Na
OH = mdd spu = 6,2 + 133,8 = 140 gam
⇒C%dd= (1,7.40)/140⋅100%=48,6%
Bài tập số 3: đến 6,9g Na cùng 9,3g Na2O vào 284,1 g nước, được dung dịch A. Hỏi bắt buộc lấy thêm từng nào gam Na
OH có độ tinh khiết 80%(tan trả toàn) bỏ vào để được dung dịch 15%
n
Na = 0,3 (mol); n
Na2O = 0,15 (mol)
Phương trình hóa học
Na + H2O → Na
OH + 50% H2
0,3→ 0,3→ 0,15 (mol)
Na2O + H2O → 2 Na
OH
0,15 → 0,3(mol)
=> n
Na
OH(sau p.ứ) = 0,6 (mol)
mdd
Na
OH(sau p.ứ) = 284,1+ 6,9 + 9,3 - 0,15.2= 300 (g)
Gọi x là kim loại của Na
OH thuần khiết 80% rước thêm.
=> kim loại chất chảy Na
OH sau thời điểm trộn vào cùng: m
Na
OH(cuối)= 0,6.23 + 0,8x = 13,8 + 0,8x (g)
Kim loại dung dịch Na
OH sau thêm là: mdd
Na
OH(cuối) = 300 + x (g)
Vì dd Na
OH cuối tất cả nồng độ 15% phải ta tất cả pt:
(13,8 + 0,8x)/(300 + x.100) =15%
⇔x = 48
Vậy nên thêm 48 gam Na
OH độ tinh khiết 80%
Câu hỏi vận dụng tự luyện:
Bài tập số 1: Ở 20o
C, 60 gam KNO3 chảy trong 190 nước thì thu được hỗn hợp bão hoà. Tính độ rã của KNO3 ở ánh sáng đó ?
Bài tập số 2: ở 20o
C, độ tan của K2SO4 là 11,1 gam. Nên hoà tan từng nào gam muối này vào 80 gam nước thì thu được hỗn hợp bão hoà ở nhiệt độ đã đến ?
Bài tập số 3: Tính khối lượng KCl kết tinh đợc sau thời điểm làm nguội 600 gam hỗn hợp bão hoà sống 80o
C xuống 20o
C. Biết độ rã S sinh sống 80o
C là 51 gam, sinh hoạt 20o
C là 34 gam.
Bài tập số 4: Biết độ tung S của Ag
NO3 sống 60o
C là 525 gam, sống 10o
C là 170 gam. Tính lượng Ag
NO3 bóc tách ra khi làm cho lạnh 2500 gam hỗn hợp Ag
NO3 bão hoà sinh sống 60o
C xuống 10o
C.
Bài tập số 5: Hoà rã 120 gam KCl cùng 250 gam nớc sinh hoạt 50o
C (có độ rã là 42,6 gam). Tính lượng muối còn thừa sau khoản thời gian tạo thành hỗn hợp bão hoà?
Bài tập số 6: Cho 6,2 gam Na2O vào 73,8 gam nước thu được hỗn hợp A. Tính độ đậm đặc của chất tất cả trong dung dịch A ?
Bài tập số 7: Cho 6,2 gam Na2O vào 133,8 gam hỗn hợp Na
OH bao gồm nồng độ 44,84%. Tính nồng độ xác suất của chất gồm trong dung dịch ?
Bài tập số 8: Cần bỏ thêm a gam Na2O vào 120 gam dung dịch Na
OH 10% và để được dung dịch Na
OH 20%. Tính a ?
Bài tập số 9. Hòa tan hoàn toàn 124 gam natri oxit vào 876 gam nước, phản nghịch ứng sinh ra natri hiđroxit. Nồng độ tỷ lệ của hỗn hợp thu được là:
Bài tập số 10. Trộn 150g dung dịch Na
OH có nồng độ 20% cùng với 50g hỗn hợp Na
OH có nồng độ 5%. Xác minh nồng độ phần trăm của hỗn hợp thu được.
Bài tập số 11. dung dịch HCl chào bán trên thị trường có độ đậm đặc phần trăm cao nhất là 37%, cân nặng riêng D = 1,19 g/ml. Hãy tính nồng độ mol/l của 10 ml dung dịch trên.
Để xem toàn thể nội dung tương tự như bài tập từng dạng bài bác tập Hóa 8 mời các bạn tham khảo tại:
Các dạng bài tập Hóa 8
..........................
Trên phía trên Vn
Doc đã giới thiệu tới chúng ta Tổng hợp phương pháp hóa học tập 8 nên nhớ. Hi vọng thông qua tư liệu trên, chúng ta học sinh sẽ dễ dãi ghi nhớ những công thức Hóa 8, giao hàng quá trình học hành được thuận tiện hơn.
Để có hiệu quả học tập giỏi và công dụng hơn, Vn
Doc xin trình làng tới chúng ta học sinh tư liệu Giải bài xích tập hóa học 8; siêng đề chất hóa học 8; Trắc nghiệm chất hóa học 8 online cơ mà Vn
Doc tổng hợp biên soạn và đăng tải.








